最新综述:如何对付“靶向无效”的癌症?
KRAS是结直肠癌(CRC)中常见的突变基因,但长期以来一直面临“靶向无药”的困境。临床研究数据支持MEK抑制剂与pI3K抑制剂联合治疗晚期结直肠癌,提高疗效,避免耐药。
也有研究探索与这些靶向抑制剂联合免疫治疗的效果。AACR最近发表的一篇综述总结了目前对RAS CRC的研究。
背景KRAS突变(mt KRAS)是目前已知的最重要的原癌基因突变之一,在结直肠癌(CRC)中的发病率约为60%。目前的临床试验数据支持MEK抑制剂联合任何pI3K抑制剂用于转移性CRC患者。该方案可避免耐药的发生,疗效优于单药治疗。
对于后续治疗选择有限的患者,也有临床研究评估免疫治疗联合不同途径的抑制剂的疗效。本文综述了直接或间接治疗KRAS突变的方法和临床研究。
直接针对KRAS的靶向治疗KRAS的表面相对光滑,使得小分子药物难以结合。近年来,对KRAS蛋白结构和功能的新认识揭示了Ras靶向替代激活的可能性。2013年,Ostrem和同事首次发现了一种化合物,可以选择性地靶向KRAS G12C突变中的12-半胱氨酸,而不抑制野生型KRAS。
这些化合物将mt KRAS G12C锁定在其非活性的GDp结合状态,通过与核苷酸结合位点附近的口袋结合,防止GTp的再极化。类似的直接靶向方法促使adagrasib、ARS-1620、ARS-853、SML-8-73-1和sotorasib的开发,作为KRAS G12C等位基因特异性抑制剂具有良好的治疗潜力。相关临床研究见表1。
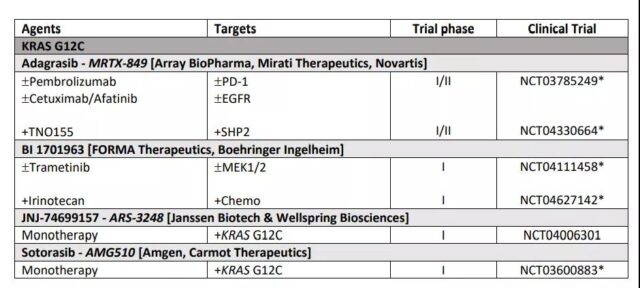
表1 KRAS突变靶向治疗大肠癌的临床研究
主要包括选择性同分异构体、pan-pI3K抑制剂和双pan-pI3K抑制剂三类。
许多pI3K选择性异构体(p110α, β, δ, γ)抑制剂用于治疗晚期实体肿瘤,血液系统恶性肿瘤和淋巴瘤的临床研究。由于p110δ和p110γ在血细胞中表达受限,与实体肿瘤相比,pI3Kδ和pI3Kγ选择性异型抑制剂在血液系统恶性肿瘤中更有效。
最近的研究表明,抑制p110α或p110β可导致pI3K信号通路的再激活,从而限制了该药物的临床疗效。这些证据支持pan-pI3K抑制剂或pI3Kα和pI3Kβ联合能够更好地抑制pI3K通路。pan-pI3K抑制剂可以靶向I型pI3K激酶的四种亚型(α, β, 214 δ, γ)。
这类药物的主要缺点是广泛的药物相关的不良反应,包括厌食、疲劳、恶心和高血糖,这限制了药物的剂量。双pI3K-mTOR抑制剂可以更有效地关闭pI3K-AKT-mTOR通路,导致肿瘤消退。虽然双pI3K-mTOR抑制剂的临床前数据和体外实验显示了良好的肿瘤抑制作用,但临床效果并不十分令人满意。
一种蛋白激酶抑制剂大多数AKT抑制剂通过干扰ATp或部分结合ATp结合位点来阻断AKT 1,2,3。虽然AKT的靶向选择性预计高于pI3K抑制剂,但临床结果并不令人满意。AKT抑制剂的副作用包括严重的皮疹和高血糖。一些药物在II/III期研究中没有显示出临床益处。Enzastaurin治疗结直肠癌的两项II期临床试验(NCT00192114和NCT00437268)已经完成,结果尚未公布。
阿斯利康(AstraZeneca)开发的Capivasertib在体内实验中被证明能抑制所有AKT亚型和AGC家族激酶。
Davies和他的同事报告说wt-RAS、pI3KCA或pTEN突变细胞系对capivasertib敏感。Capivasertib在实体瘤患者中的I期试验(NCT01353781)显示间歇性给药具有抗肿瘤活性,II期联合治疗研究(NCT02576444)目前正在进行中。
mTOR抑制剂
大多数mTOR抑制剂单药治疗mCRC的研究都没有显示出临床益处。这可能与elF4E结合蛋白1激酶引起的耐药有关。结合上游受体抑制剂已成为研究的热点。
I/II期临床研究显示,依维莫司联合改良FOLFOX-6+贝伐单抗一线治疗mCRC患者,96%的患者pFS超过6个月(NCT01047293)。一项多中心II期研究(NCT01058655)显示,依维莫司联合另一种VEGF抑制剂tivozanib耐受性良好。依维莫司联合伊立替康和西妥昔单抗对复发KRAS野生型mCRC患者显示出益处(NCT00478634和NCT00522665)。
英国皇家空军抑制剂第一代BRAF抑制剂靶向BRAF激酶结构域,包括vemurafenib、dabrafenib、encorafenib和sorafenib,这些药物已经在BRAFV600E mCRC患者中进行了试验。
Vemurafenib单药治疗无效,联合治疗可提高疗效。上海长征医院目前正在招募晚期BRAFV600E mCRC患者,评估vemurafenib+西妥昔单抗+FOLFIRI (NCT03727763)的疗效。
达非尼联合帕妥珠单抗和MEK1/2抑制剂曲美替尼具有抗肿瘤活性。
恩克拉非尼目前正在进行多项III期研究,包括尼鲁单抗、西妥昔单抗、MEK抑制剂(binimetinib)、pI3Ka抑制剂(alpelisib)、细胞毒性药物(5-FU、贝伐单抗)、卡培他滨、伊立替康、亚叶酸钙、奥沙利铂等)联合治疗,前景广阔。
MEK抑制剂
最有前景的MEK抑制剂是binimetinib和曲美替尼,II/III期临床研究正在进行中。
ERK抑制剂RAF和MEK耐药与ERK1/2的再激活有关,因此阻断ERK1/2可以克服上游RAF和MEK抑制剂的耐药问题。但ERK抑制剂的疗效是否优于MEK抑制剂尚不清楚。
免疫检查点抑制剂ICIs在CRC中的临床益处主要局限于高度不稳定的微卫星(MSI/dMMR)患者。这一亚组约占所有crc的15%。MSI-H CRC具有大量肿瘤浸润淋巴细胞(TILs)和肿瘤微环境高免疫原性的特点。值得注意的是,MSI-H患者的pD-1、pD-L1和CTLA-4表达水平较高。
因此,ICIs阻断pD-1/pD-L1和CD80/CTLA4可增强T细胞活化,促进肿瘤细胞杀伤。临床前实验报道pD-1或pD-L1抗体联合MEK抑制剂有协同治疗作用。动物实验表明,该联合治疗可显著抑制肿瘤生长,增加肿瘤内CD4+和CD8+ T细胞数量。
2018年,ipilimumab联合nivolumab或nivolumab被批准用于MSI-H mCRC。II期NICHE和CheckMate142研究目前正在进行中。本研究主要评估ipilimumab、nivolumab联合COX2抑制剂塞来昔布、MEK抑制剂cobimetinib、抗cd38抗体daratumumab或抗lag3抗体BMS 986016治疗CRC的疗效(NCT03026140、NCT02060188)。与此同时,有研究报道单剂量ipilimumab联合双剂量nivolumab对dMMR患者有效。
最近,随着NCT03785249、NCT03475004、NCT03374254、NCT02563002等的研究,pembrolizumab被批准用于MSI mCRC。Le和同事发现MMR状态与患者使用派姆单抗的获益相关(NCT01876511), pFS率为78%。Andre和Le的研究进一步支持派姆单抗作为MSI-H结直肠癌的单药治疗。但派姆单抗联合治疗MMR CRC无临床获益(NCT02981524)。另一项II期研究评估了pD-L1抗体Avelumab (NCT03150706)对MSI-H或pOLE突变型mCRC的疗效。Atezolizumab单克隆抗体治疗dMMR/MSI-H mCRC有少量研究(NCT02997228, NCT03866239, NCT02912559)。
到目前为止,ICIs在dMMR/MSI-H亚组患者中已经非常成功,但它们对MMR CRC患者不敏感。需要进一步努力确定哪些亚组患者可以受益于ICI联合治疗。预计ICI将尽快成为dMMR mCRC的标准治疗方案。
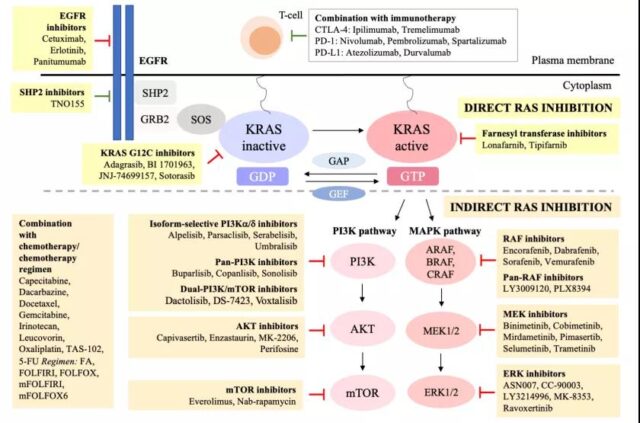
图1 KRAS靶向治疗大肠癌示意图(来源:参考文献1)
总结:总之,随着分子治疗的发展,结直肠癌的治疗取得了很大的进展。早期关注的重点是上游pI3K和RAF抑制剂的发展,以阻断mTOR和ERK的激活。后来发现,RAS肿瘤细胞可以通过动态重组下游信号网络重新激活mTOR和ERK,导致对上游抑制剂的耐药性。
不同的分子亚型将显著影响CRC的预后和治疗策略。这意味着未来的CRC临床研究需要考虑多药耐药机制、不同分子亚型、患者预后、生物标志物等分层因素。目前,一些靶向抑制剂和免疫检查点抑制剂联合治疗的临床研究正在进行中。






























