新发现!转录组+蛋白组+代谢组三组学联合揭示前列腺癌病理机制及独立预后生物标志物
前列腺癌(pCa)是全球第二常见的癌症,也是男性癌症死亡的第五大原因。前列腺活检后的治疗是个性化的,但目前仍然存在过度治疗或治疗不足的风险很大,迫切需要额外的风分级生物标志物。
维也纳医科大学病理部Lukas Kenner研究团队在《Molecular systems biology》(IF:11.429,中科院JCR 1区)上发表题为“STAT3-dependent analysis reveals pDK4 as independent predictor of recurrence in prostate cancer”的研究论文。研究者利用转录组学数据的基因共表达网络,以及来自人和鼠前列腺FFpE-激光显微切割样本的蛋白质组学,寻找前列腺癌潜在的风险分级生物标志物。在转录水平上显示了氧化磷酸化(OXpHOS)的上调,在蛋白质组水平上显示了TCA循环/OXpHOS的上调,这与STAT3的表达呈负相关。同时,作者鉴定到TCA循环的关键调节因子──丙酮酸脱氢酶激酶4 (pDK4)基因的表达,独立于其他诸如分级、分期和前列腺特异性抗原(pSA)水平的诊断风险因素,低pDK4是前列腺癌预后不良的一个有前景的标志物。
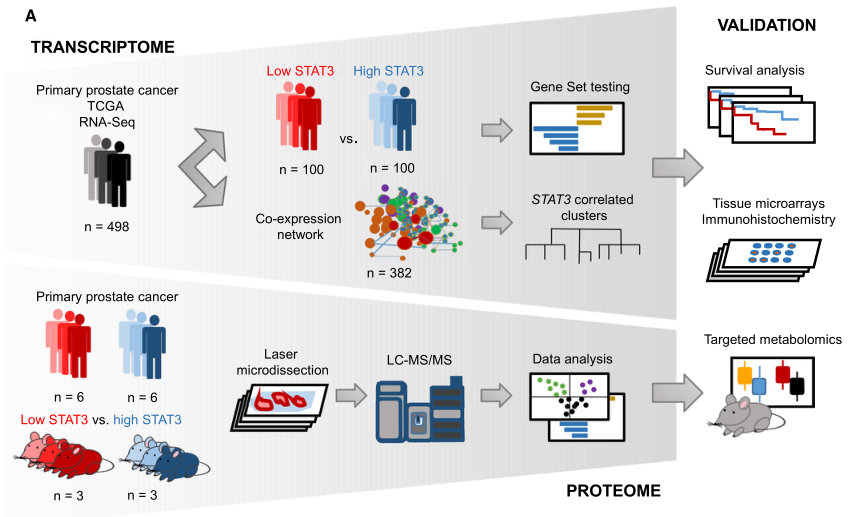
总体技术路线
研究结果
原发前列腺癌中低STAT3表达与高的氧化磷酸化(OXpHOS)和核糖体生物合成相关作者先分析了498名原发前列腺癌患者的TCGA pRAD RNA-Seq数据,并进行了如下两个方向的探索:
(1)比较低STAT3和高STAT3患者的差异基因。
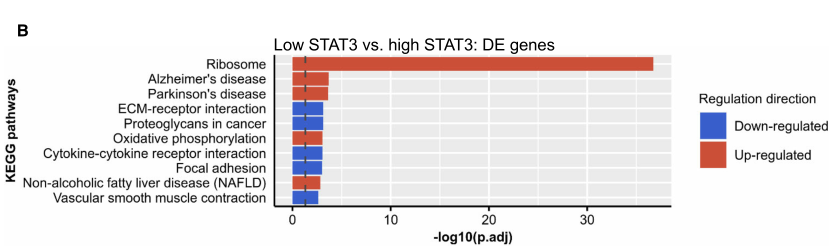
共发现有1194个显著差异基因(FC ≥ 2,FDR ≤ 0.05)。KEGG通路富集显示核糖体和氧化磷酸化(OXpHOS)在显著上调的通路中。同时,和低STAT3组相比,STAT3的靶基因在高STAT3组中显著上调。表明STAT3基因表达与其作为转录因子的活性相关。STAT3在酪氨酸磷酸化(pY)的形式下作为转录因子发挥作用。
(2)进行WGCNA共表达网络分析,以获得高度相关的基因簇。
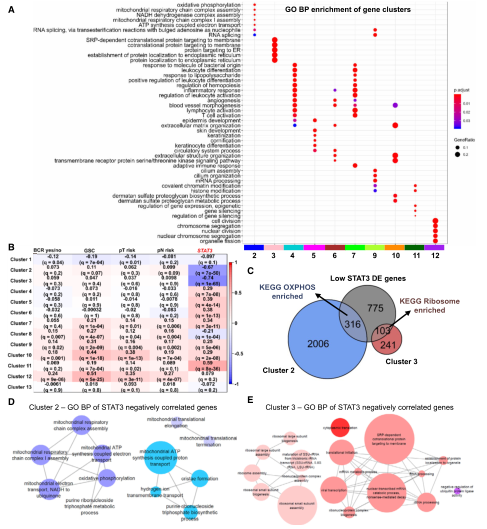
共得到了13个基因簇,GO分析获得了每个基因簇富集的生物过程(下图A)。簇2中的基因主要与细胞呼吸(OXpHOS,“线粒体呼吸链复合体组装”和“RNA剪接”)相关。簇3代表核糖体翻译和靶向内质网的蛋白质。簇2和簇3与STAT3表达有相对更显著的负相关关系(下图B)。前50个负相关基因的GO生物过程分析又进一步表明,STAT3表达与OXpHOS和核糖体活性相关的基因呈负相关(下图D&E)。
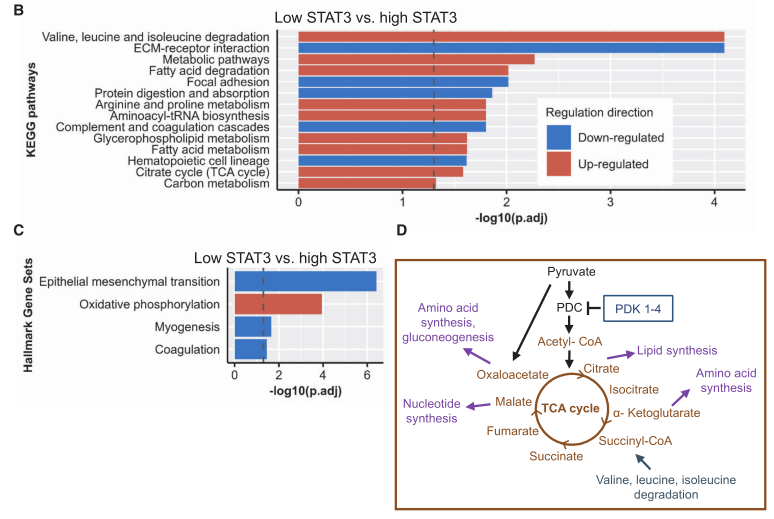
研究人员对GSC分级为7、8的各6个前列腺癌FFpE样本和7个健康前列腺组织FFpE样本进行蛋白质谱检测。共检测到1949个蛋白,pCA并未有清晰的分组,三组间也未分析得到显著差异蛋白。而高STAT3和低STAT3组间比较得到30个差异蛋白(FC>2)。与前述TCGA分析结果一致,代谢途径“OXpHOS”和KEGG途径“TCA循环”被上调。“上皮间质转化”和KEGG途径“细胞外基质-受体相互作用”、“局部粘附”和“蛋白质消化和吸收”被下调。与转录组数据相似,低STAT3样品显示OXpHOS基因组的富集。此外,TCA循环被上调,以及为TCA循环提供中间体的支链氨基酸降解和脂肪酸降解也上调了(下图)。
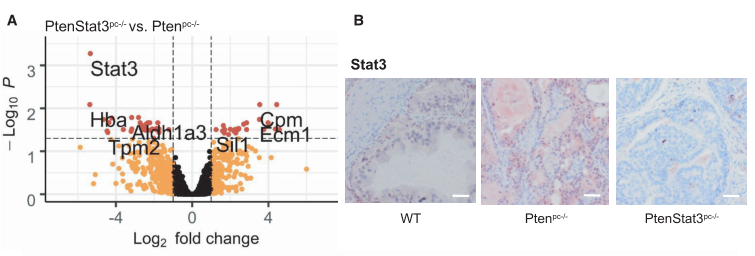
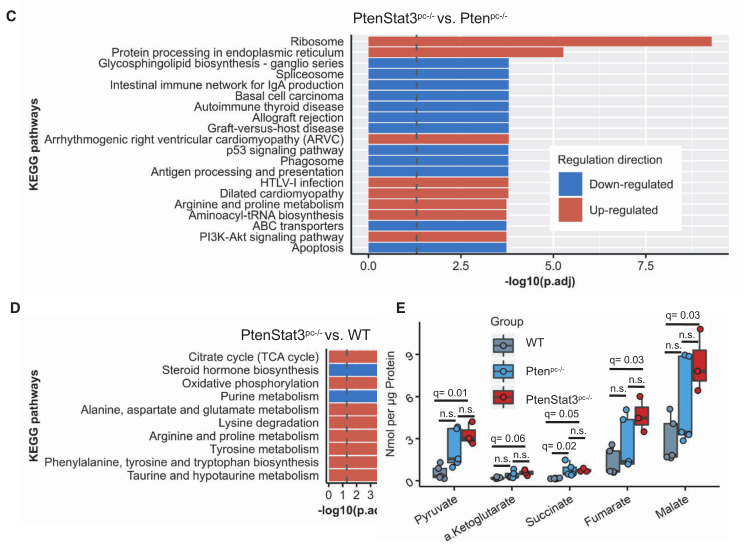
为了了解前列腺癌小鼠模型的蛋白组学是否可以反应从人样本中得到的结果,作者使用了此前构建的基因工程前列腺癌小鼠模型:前列腺上皮细胞中条件性缺失pten(ptenpc-/-)或pten和Stat 3共缺失(ptenStat3pc-/-)小鼠模型。研究者从每个基因型(野生型(WT)、ptenpc-/-和ptenStat3pc-/-中各取3只小鼠的FFpE激光显微切割(LMD)样本进行蛋白质组检测。平均检测到2994个蛋白质(2052-3465),其中1510个在所有三组之间差异表达(F≥1,FDR< 0.05)。pCA主成分分析显示各组之间有明显的差异。ptenStat3pc-/-和ptenpc-/-比,STAT3是差异表达最显著的蛋白(下图A和B),KEGG富集分析中“核糖体”和“内质网中的蛋白质加工”最为显著(下图C)。由于研究者观察到人样本中的代谢变化,在pCa小鼠模型中进一步研究了这些变化,发现ptenpc-/-与WT,TCA循环和氧化磷酸化的上调(下图D)。
随后,研究者对WT(n=5)、ptenpc-/-(n=5)和ptenStat3pc-/-(n=3)的小鼠进行了非靶向代谢组检测,最终发现,与WT相比,TCA循环相关的代谢物在ptenStat3pc-/-中显著高表达(下图E)。
鉴于前面研究发现TCA/OXpHOS的上调,作者想探究是否有TCA/OXpHOS相关基因可作为潜在的生物标志物。作者对来自80个患者的原发性前列腺癌和癌旁组织进行了SDHB(琥珀酸脱氢酶复合体帖硫亚基B)和IDH2(异柠檬酸脱氢酶2)的IHC染色,最终确认,和正常组织相比,SDHB和IDH2在肿瘤组织中高表达,其中Gleason分级5的肿瘤样本中SDHB和IDH2的表达丰度比Gleason4级和3级的表达丰度都更高(下图A、B、C&D)但IDH2和SDHB蛋白与生化复发(BCR)等并未有显著相关性。
考虑到TCA循环的激活和OXpHOS的增强在前列腺癌发生中是非常重要的事件,但本研究并未发现其和生化复发(BCR)之前的显著关系,于是研究者想要去找能拮抗TCA/OXpHOS的基因。
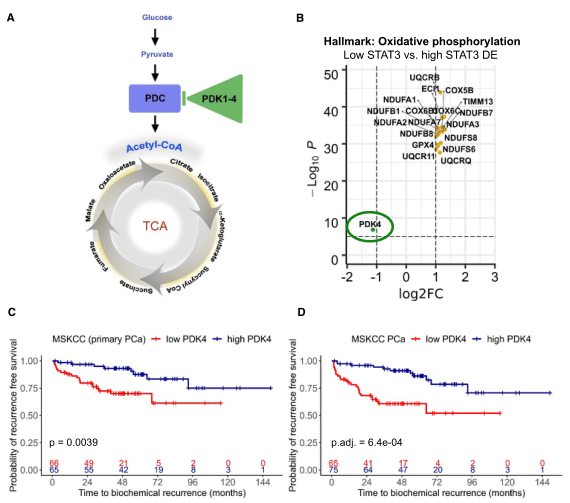
在前述的TCGA数据中,丙酮酸脱氢酶激酶4(pDK4)在低STAT3组中是显著低表达的(下图B)。丙酮酸脱氢酶激酶(pDK)包括pDK1-4,能磷酸化丙酮酸脱氢酶复合体(pDC),降低其活性,结果就是TCA循环和OXpHOS的代谢通量降低(下图A)。研究者在一个已发表的MSKCC数据中分析了pDK4表达和前列腺癌的生化复发(BCR)的关系。最终发现,pDK4是原发前列腺癌或转移性前列腺癌的生化复发(BCR)预测因子(下图C&D)。此外,研究者还进一步确认,pDK4是独立于ISUp分级、临床肿瘤分期以及病理肿瘤分期和肿瘤术前pSA(前列腺特异性抗原)水平的原发性和转移性前列腺癌的预测因子。其他4个测试数据的结果也显示了同样的趋势:低pDK4水平预示着更早的生化复发或死亡。
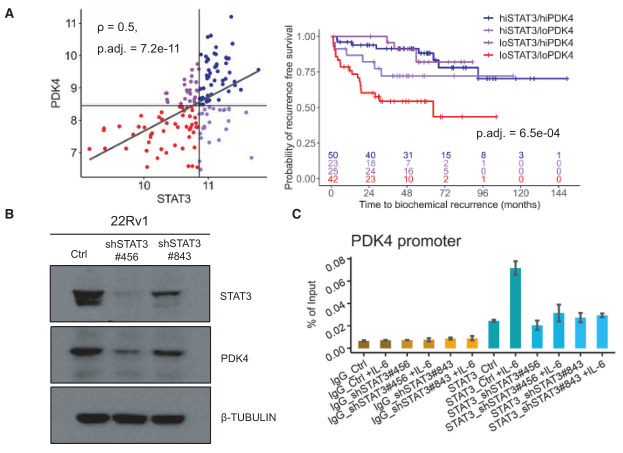
为了研究STAT3和pDK4联合对生化复发(BCR)的影响,作者将患者重新分组为:低STAT3/低pDK4、高STAT3/高pDK4和混合组(低STAT3/高pDK4和高STAT3/低pDK4),并发现低STAT 3/低pDK4显示了更早的生化复发(下图A)。
在人前列腺癌细胞系22Rv1的WB实验中,STAT3敲低细胞(shSTAT3)中pDK4的表达水平降低,这意味着STAT3对pDK4有调控作用(下图B)。为验证pDK4是否可能是STAT3的直接转录调控靶标,作者通过分析已发表的STAT3-ChIp-seq结果确认STAT3可以结合pDK4的启动子。作者又通过在前列腺癌细胞系22Rv1中的ChIp-pCR及WB实验进一步确认了STAT3对pDK4的转录调控(下图C)。
总结
▪研究团队通过分析STAT3高和低的前列腺癌转录组数据发现,低STAT3表达与高的氧化磷酸化(OXpHOS)和核糖体生物合成相关。
▪接着分别用人和小鼠的前列腺癌FFpE样本进行了蛋白组学分析,进一步确认了低STAT3表达与高的氧化磷酸化(OXpHOS)和核糖体生物合成相关。
▪在随后的分析中,研究者又发现,一个在TCA循环和氧化磷酸化(OXpHOS)中起重要作用的丙酮酸脱氢酶激酶4(pDK4)和前列腺癌的生化复发相关。
▪最终确认,pDK4是一个独立于其他诸如分级、分期和前列腺特异性抗原(pCA)水平的前列腺癌预后标志物,具有潜在的临床应用价值。
做蛋白组学• 找吉凯
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRp平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,蛋白质组学平台拥有多台timsTOF pro、Exploris 480高精度质谱仪,专业领先的Spectronaut plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、pRM、磷酸化修饰组等检测服务,强大的机器学习算法、IpA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效。