广州健康院在不对称羰基化反应中取得新进展
经过四十多年的发展,过渡金属催化的羰基化反应已经成为向分子中引入羰基的最为直接有效的手段。这类反应一般具有条件温和、底物适用性好的特点,而且根据亲核试剂的不同,可以得到不同类型的羰基化合物。一氧化碳作为便宜易得的C1来源,也符合近年来绿色化学的发展要求。羰基化反应不仅在学术界取得了丰硕的成果,在工业界也得到了广泛的应用。
然而,过渡金属催化的不对称羰基化反应是羰基化领域的一个难点。这是因为一氧化碳可以作为配体与金属中心发生配位,从而影响手性配体的调控。因此,过渡金属催化的不对称羰基化反应是有机合成领域中一项非常具有挑战性的课题。之前成功的例子主要集中在过渡金属(pt, Rh, pd)催化的烯烃的氢羰基化类型的反应上,这类反应通常需要较高压力的CO和H2,反应条件比较苛刻,产物的结构也比较单一。
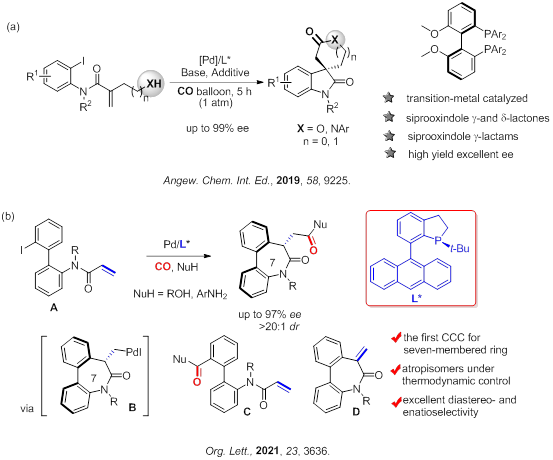
含手性季碳氧化吲哚螺内酯/内酰胺化合物存在于许多天然产物和生物活性分子中,这类化合物骨架的手性合成一直是有机合成化学家们关注热点。金属钯催化的羰基化反应无疑是合成内酯/内酰胺的最便捷的方法之一。但是,手性配体诱导的不对称羰基化反应仍然存在一定的难度。在碳钯中间体不能进行β-H消除的情况下,插入一氧化碳,高立体选择性构建含手性季碳中心的不对称羰基化反应更是寥寥无几。中国科学院广州生物医药与健康研究院朱强研究员和罗爽副研究员团队成功实现了钯催化的不对称Heck/羰基环化反应。该反应中,烯烃在一氧化碳插入后,与分子末端羟基/胺基发生酯化/酰胺化,是一种合成手性季碳氧化吲哚螺内酯/内酰胺的通用方法。值得一提的是,螺环大小可以通过烯基与末端亲核原子的距离进行调控。通过该合成方法,可方便地实现天然产物Coixspirolactams A的高效合成,并首次完成了其绝对构型的鉴定。同时运用该方法为核心步骤,首次实现了CRTH 2受体拮抗剂的不对称合成。该成果于2019年发表在Angew. Chem. Int. Ed.上。
最近,该团队在不对称羰基化反应领域又有了新的进展,实现了钯催化不对称7-exo-trig Heck羰基化串联反应合成二苯氮杂卓酮类阻转异构体。不对称Heck羰基化策略是构建环状羰基化合物最高效的合成方法之一,目前,通过该策略已经成功实现了五元和六元环状羰基化合物的构建,然而,构建七元环状羰基化合物的反应至今尚未报道。对于七元环的构建难点在于:1)芳基钯的直接羰基化和烯烃的迁移插入存在竞争;2)减少烯烃上的取代基后,烷基钯的β-H消除反应和CO插入反应也存在竞争。为了解决上述难题,该团队创造性地使用刚性的联芳基将碘苯和烯烃连接,首次实现了对映选择性的7-exo环碳钯引发的Heck羰基化串联反应,合成了一系列的二苯氮杂卓酮类化合物,反应的对映选择性和非对映选择性都非常出色。反应底物适用性宽泛,并且能对轴手性的消旋底物进行高选择性的动力学拆分,甚至能够兼容一些临床药物分子。实验结果和DFT计算结果相互验证,证明该二芳基轴的轴手性由环上新形成的手性中心热力学控制。该成果在线发表于Org. Lett.上。
论文第一作者为广州健康院2018级博士研究生胡华安子,朱强研究员、罗爽副研究员为共同通讯作者。该研究得到了国家自然科学基金(编号:21772198、21871268、22071250)、生物岛实验室前沿研究计划(广州再生医学与健康广东省实验室)(2018GRZ110105017)、广东省自然科学基金会(2020A1515011428),以及广西省“八桂学者”计划的资助。同时,该研究也得到中科院超级计算中心广州分中心的支持。
论文链接
广州健康院在不对称羰基化反应中取得新进展






























