基于表观遗传异质性的肺腺癌病人分型模型
2021年5月17日,国际期刊Genome Biology在线发表了复旦大学附属肿瘤医院孙艺华主任、中国科学院上海营养与健康研究所邵振研究员和分子细胞科学卓越创新中心季红斌、孟飞龙研究员多家课题组的合作研究成果“A systematic dissection of the epigenomic heterogeneity of lung adenocarcinoma reveals two different subclasses with distinct prognosis and core regulatory networks”。
肺癌是目前世界死亡人数最多的恶性肿瘤,其中肺腺癌是最常见的病理类型。它的总体预后仍然较差,并在病理形态、基因突变等方面表现出高度异质性,即便相同疾病阶段的患者也往往存在很大预后差别。以往研究系统分析了这些差异,建立了多种分类模型,其中病理亚型分型已得到广泛临床应用。表观遗传变化同样是癌症发生发展的重要环节,但我们对其在肺腺癌中的作用还知之甚少。
该项目收集生成了42例肺腺癌病人肿瘤和瘤旁正常肺组织的RNA-seq和H3K27ac组蛋白修饰ChIp-seq数据。通过应用邵振组开发的MAnorm2模型,获得了数千个肿瘤和正常组织之间的差异H3K27ac修饰位点,进而鉴定了它们各自特异的增强子和超级增强子。但是,这些差异调控位点难以解释病人肿瘤之间的高度表观异质性。因此,研究人员基于MAnorm2设计了一个新计算模型,对病人肿瘤间的表观异质性进行定量计算建模,鉴定了4615个病人间显著高差异的H3K27ac修饰位点,并基于它们对病人进行了分型,定义了两组总体和无复发生存时间存在显著差异的亚组Group I(G I,预后好)和Group II(G II,预后差)。进一步通过超级增强子和差异表达等计算和实验分析,发现G I特异的超级增强子下游富集了更多与细胞谱系分化相关的转录因子,而G II则偏向处于更高的细胞增殖和去分化状态。
为探索这个基于表观组的肺腺癌分型模型能否应用于其他病人,研究人员利用两个亚组各自的特征基因集,将TCGA数据库中的肺腺癌病人分为G I-like和G II-like两组,并发现他们具有显著不同的生存时间,而且G II-like病人总体上具有更高的肿瘤突变负荷和更多的抑癌基因突变。其中,即使是被临床诊断鉴定为TNM stage I的TCGA病人,被判定为GII-like的病人同样表现出显著更差的预后,说明该分型模型可作为TNM分期的有益补充。为进一步探究导致两个亚组不同临床表型的调控机制,研究人员围绕亚组间差异表达调控因子系统构建了基因共表达网络,从中定义出两个亚组各自的核心调控因子,并发现G I的核心调控因子调控了很多经典抑癌基因。基于这一模式,研究人员鉴定出一个新肺腺癌抑癌基因CLU,并通过基因过表达实验证实其能够抑制肺腺癌细胞增殖,而该基因的敲低以及其上游GI特异性增强子的敲除均导致肺腺癌细胞增殖加快。因此,抑癌基因的进一步失能很可能是G II具有更差预后的重要原因之一。
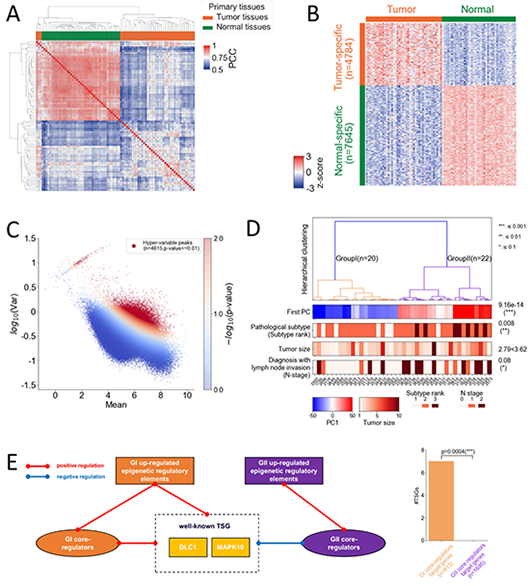
图:(A)肺腺癌病人肿瘤组织表现出更高的表观异质性。(B)MAnorm2鉴定的肿瘤和瘤旁正常组织之间差异H3K27ac修饰位点。(C)鉴定病人肿瘤组织间显著高差异的H3K27ac位点。(D)基于病人肿瘤表观异质性将42例肺腺癌病人分为病理显著不同的两个亚组。(E)两个亚组各自特异的核心调控因子和表观调控元件对抑癌基因的差异调控作用。
该研究工作得到科技部国家重点研发计划、国家自然科学基金、中科院先导科技专项等项目资金支持。复旦大学附属肿瘤医院医生袁崇泽、中国科学院上海营养与健康研究所博士生陈浩杰、博士后涂世奇以及分子细胞科学卓越创新中心黄馨怡为论文共同第一作者。
文章链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-021-02376-1






























