研究人员揭示蛋白相分离抑制天然免疫过度活化机制
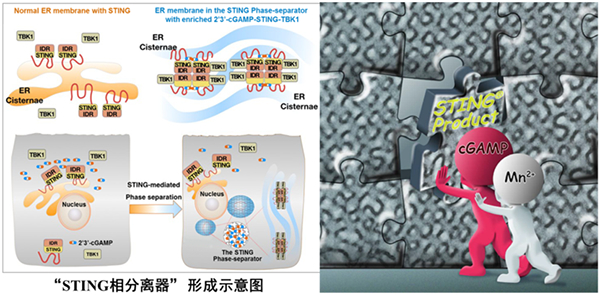
图1 “STING相分离器”吸附并隔离天然免疫关键分子,防止天然免疫反应过度活化
在国家自然科学基金重点项目(批准号:31830022)等资助下,北京大学蒋争凡课题组发现STING蛋白相分离形成内质网立方膜结构调节天然免疫过度活化的机制,相关成果以“STING相分离器抑制天然免疫信号(The STING phase-Separator Suppresses Innate Immune Signaling)”为题,于2021年4月8日以Research Article形式发表在著名学术期刊《自然-细胞生物学》(Nature Cell Biology)。论文链接:https://dx.doi.org/10.1038/s41556-021-00659-0。
抗病毒天然免疫如何在病毒感染早期有效地启动并在晚期及时的终止以避免免疫损伤,已经成为过去二十年中生物医学的前沿热点问题。STING蛋白(亦称MITA/ERIS)是分布于内质网的4次跨膜蛋白,与cGAS产生的2’3’-cGAMp结合后被转运于高尔基体来源的小膜泡,从而活化诱导产生I-型干扰素等细胞因子,实现细胞抗病毒天然免疫应答。STING活化过程中依赖于高尔基体的膜转运机制与生理意义一直是领域内的未解之谜。
立方膜结构(Cubic membranes)是由生物膜堆叠形成高度组织化的三维周期性特殊结构,几乎存在于所有生命体的各种细胞中。但学界对这种立方膜的形成机理和生理病理功能一直了解甚少。
蒋争凡教授发现在DNA病毒感染细胞的后期,未发生高尔基体转运的STING蛋白在内质网膜上形成相分离液滴;通过光镜-电镜联合技术与免疫电镜技术,发现STING蛋白形成的凝集体是由内质网膜形成的、高度特化的膜结构。三维重组研究结果提示此种细胞核周围形成“蜂窝状”的“类细胞器”样结构,非常类似于艾滋病患者淋巴细胞中广泛存在的内质网“立方膜结构”。他们在体外重建了STING蛋白的相分离,发现体外诱导形成的液滴也具有一定的内在结构。蒋争凡教授课题组将这种STING相分离形成的内质网“立方膜结构”命名为“STING相分离器”,并揭示了相分离器的生理学意义在于空间上将STING及其下游激酶TBK1与关键转录因子IRF3进行“隔离”,从而负调节cGAS-STING通路,抑制天然免疫过度活化(图1)。
该项成果从蛋白相分离的角度揭示细胞内独特膜结构的形成与生理病理功能,具有重要的理论和实际意义。






























