新型基因编辑工具脱靶检测方法GOAT证明CRISPR-Cas12a不存在明显的脱靶效应
2021年4月2日,《protein & Cell》发表了一篇名为《Indiscriminate ssDNA cleavage activity of CRISpR-Cas12a induces no detectable off-target effects in mouse embryos》的研究论文,该研究由中科院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心周昌阳研究组、杨辉研究组、孙怡迪研究组以及中国农业科学院深圳农业基因组研究所左二伟研究组合作完成。该研究在GOTI的基础上,建立了一种新型检测基因编辑脱靶的方法—GOAT,并使用该方法证明了CRISpR/Cas12a靶向激活的随机单链DNA切割活性不会在小鼠胚胎中导致可检测的脱靶。此研究在提高基因编辑技术脱靶检测敏感性的同时,克服了GOTI技术中可能遇到的二细胞注射泄露、大量的流式分选以及流式分选假阴性等问题,同时证明了CRISpR/Cas12a这种基因编辑工具的安全性。
基因编辑工具潜在的脱靶风险一直备受关注。之前的基因编辑脱靶检测工具更多地专注于检测基因编辑过程之中所产生的双链断裂,而一些诸如单碱基编辑的脱氨酶所产生的脱靶效应并没有得到很好的评估。2019年,左二伟等人开发了一种GOTI技术能够在不受个体单核苷酸多态性的影响下,检测基因编辑工具的脱靶,并证明了BE3在用于小鼠胚胎编辑时会产生大量的单核苷酸脱靶突变。GOTI技术在二细胞小鼠胚胎其中一个卵裂球中注射基因编辑工具并标记上红色荧光,14.5天的时候通过流式分选得到注射以及未注射卵裂球的后代细胞,并通过全基因组测序的方法对比两组细胞DNA序列的差异,从而分析其脱靶效应。然而,GOTI技术中存在一些问题限制了其广泛的应用:二细胞时期胚胎并没有完全分开,注射的液体可能会存在一定的泄露;14.5天将两组细胞分开需要进行大量的流式分选;流式分选中会存在一些假阴性等。
为了避开上述问题,周昌阳研究组与合作者开发了一种名叫GOAT的技术。小鼠胚胎发育至二细胞时期时,将两个卵裂球分开,得到一对双胞胎小鼠。将基因编辑工具注射到其中一个胚胎,发育至12.5天的时候,对比编辑以及未编辑的胚胎的全基因组测序数据,即可分析得到基因编辑工具可能导致的脱靶效应。利用该方法检测BE3以及ABE的小鼠胚胎中的脱靶效应,与GOTI的检测结果并没有显著性差异。
在证明了该方法的有效性之后,研究者进一步检测了CRISpR/Cas12a在小鼠胚胎中的脱靶效应。CRISpR/Cas12a是另外一种广泛使用的基因编辑工具,之前的体外实验证明其在切割靶向的双链DNA之后会激活无差别的单链DNA切割活性。而细胞在DNA的复制以及RNA的转录等过程之中会形成单链DNA结构,这种单链DNA结构是否会被Cas12a切割有待进一步验证。利用GOAT方法,研究人员证明了CRISpR/Cas12a在用于小鼠胚胎编辑时,并不会产生可检测的脱靶。分析其原因,可能由于CRISpR/Cas12a在用于基因编辑时,其在细胞内靶向的DNA拷贝数是极少的,只能激活有限的Cas12a蛋白,并不能造成大量的单链DNA的切割,同时细胞的DNA修复机制也可以修复这些少量的单链DNA断裂。该工作证明了CRISpR/Cas12a是一种高特异性的基因编辑工具,为其临床应用奠定了基础。
该工作由中国科学院脑科学与智能技术卓越创新中心博士研究生魏喻、博士后周英思、刘亚京等在脑科学与智能技术卓越创新中心青年研究员周昌阳、研究员杨辉、青年研究员孙怡迪以及中国农业科学院深圳农业基因组研究所研究员左二伟的指导下完成,研究组的其他成员积极参与,是众多研究组合作的成果。该工作得到科技部,中科院,上海市的资助。
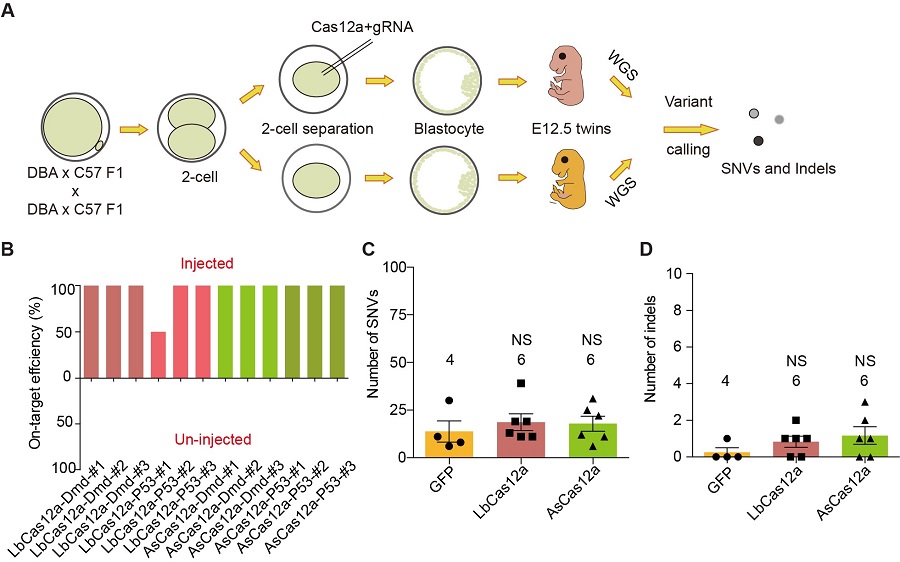
(A) 实验流程。(B) 注射以及未注射胚胎目的位点的编辑效率。 (C) 点突变脱靶数目的比较。 (D) 插入或缺失脱靶数目的比较。






























