为什么麻醉剂会阻止细胞行走
这不一定是坏事,但它的工作原理直到现在还是个谜。
Rice大学的理论生物物理中心(CTBp)的研究人员详细阐述了异丙酚(一种在手术前注射用来麻醉你的全身麻醉剂)阻止驱动蛋白沿着微管将货物输送到细胞的远端。
物理学家JoséOnuchic说,我们的蛋白质计算机模拟清楚地显示了它与驱动蛋白结合的位置以及它如何破坏驱动蛋白的功能。
“细胞中的很多东西都受到微管和运动蛋白的调控,包括有丝分裂和细胞器和小泡的运输,因此对它们如何工作的任何了解都是重要的,”Onuchic说。
“我们现在对驱动蛋白的重要区域有了更多的信心,我们可以在这些区域寻找更多的小分子粘合剂,”博士后研究员Biman Jana。“这将有助于发现更好的麻醉剂,并治疗与驱动蛋白有关的几种疾病。”研究发表在《pNAS》上。
研究人员知道异丙酚在诱导麻醉时会影响体内的许多蛋白质,他们怀疑驱动蛋白抑制可能是麻醉剂影响记忆和意识的原因之一。
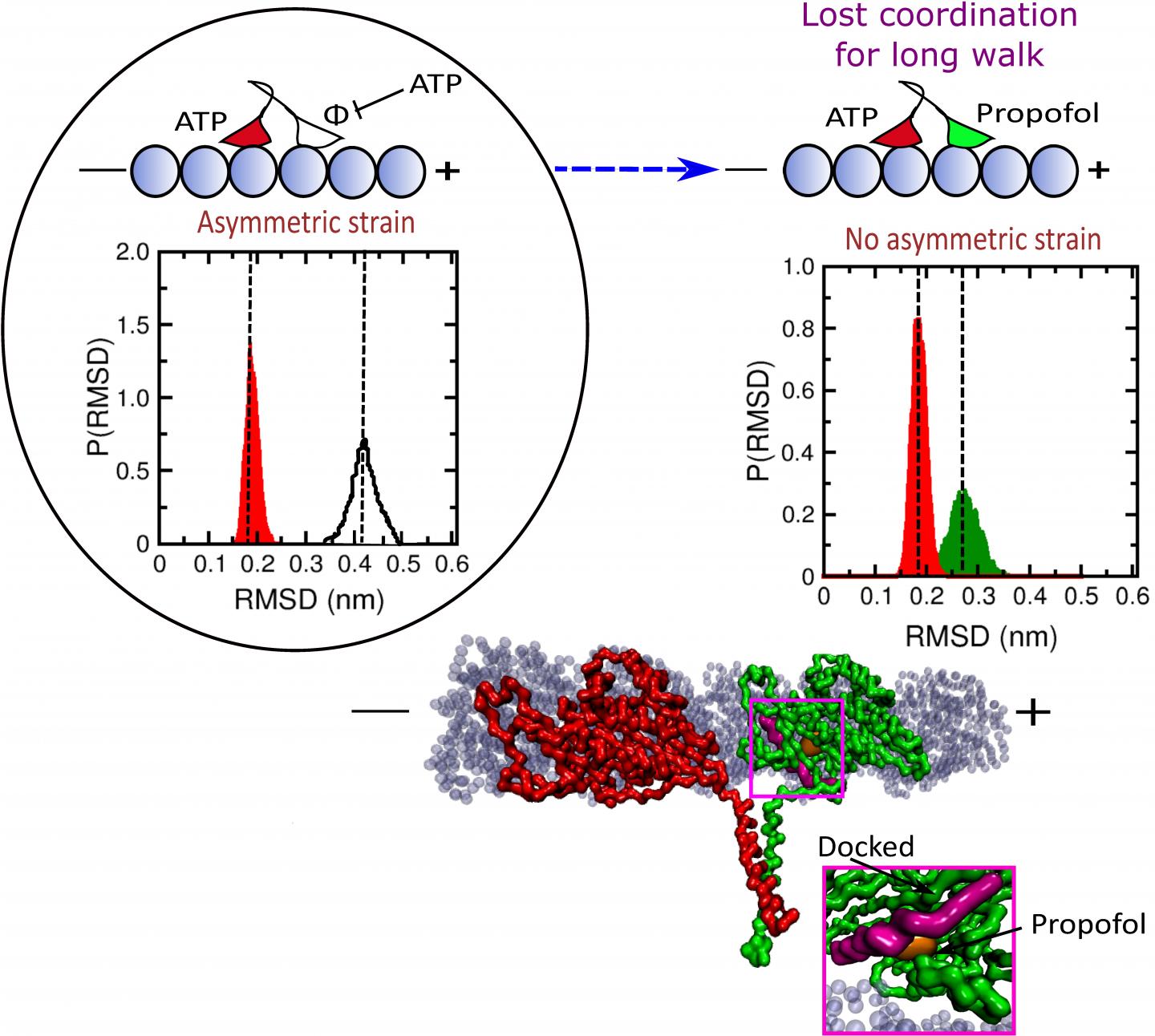
驱动蛋白最早于1985年在鱿鱼身上被发现,但现在在人类身上有45种已知的驱动蛋白,其中38种存在于大脑中,多达20种在细胞中调节运输。它们沿着微管走了大约100步。它们的蛋白质头部(起着脚的作用)是由来自ATp的化学能提供动力的,当ATp与前脑结合时,会推动后脑向前。随着后脑的推进,它成为前脑,释放ADp并抓住微管。
当两个头都在微管上时,这是行走周期中的一个正常阶段,重要的是ATp不能与头部保持结合。如果发生这种情况,ATp可以在两个头部水解,促使驱动蛋白从微管释放,停止其运动。异丙酚的结合使这个“行程”缩短了60%。
“和我们一样,这些蛋白必须至少有一只脚踩在地上。当两个头都解开时,这会打乱整个过程。”
模拟显示异丙酚分子通过两个位置中的一个与前导头部结合而产生干扰,要么靠近调节行走头部之间通讯的颈部连接体,要么靠近它与微管结合的部位。这削弱了它的抓地力和颈部连接体的张力,促使头部与ATp结合,而头部与微管结合。结合在两个头上的ATp可能导致两个头的水解,然后释放驱动蛋白。
研究人员在他们的模拟实验中发现,异丙酚在与后脑结合时对驱动蛋白的正常工作没有直接影响。他们还将异丙酚的模型转换成氟哌啶醇,一种用氟化物取代羟基的衍生物,发现氟哌啶醇不影响驱动蛋白的功能,这表明异丙酚中氢键的重要性。
Jana说:“根据我们以前研究与神经退行性疾病相关的驱动蛋白的经验,我们了解驱动蛋白的重要区域和相互作用,以确保其可靠的功能。在完全相同的区域发现异丙酚结合袋是一个惊喜。”
原文检索:Mechanistic basis of propofol-induced disruption of kinesin processivity
(生物通:伍松)