呼吸,始于微不足道的电子变化
呼吸是所有生物的一个基本过程,产生能量,保持健康和生存。在细胞中,呼吸涉及 “呼吸蛋白”,例如血液中的血红蛋白和肌肉中的肌红蛋白。
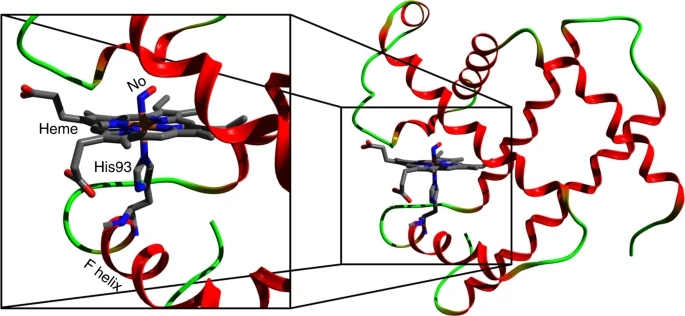
呼吸蛋白的工作原理是结合和释放小分子,如氧、一氧化碳等,称为配体。它们通过它们的“活性中心”来实现这一点,在许多呼吸蛋白质中,活性中心是一种叫做血红素卟啉的化学结构。
结合和释放小分子会引起血红素分子和电子结构的变化。这种变化是从平面的低自旋连接体卟啉形态向半球形高自旋非连接体形式的转变,反之亦然。这种转变是呼吸的关键步骤,最终在“放松”和“紧张”构象之间转换血红蛋白。
电子绕着原子旋转,也绕着自己旋转,可以从一种自旋状态过渡到另一种自旋状态。关于从低自旋平面态向高自旋半球形血红素转变的争论主要由两个学派主导:由热松弛导致,二由电子自旋态之间的级联导致。
现在,由EpFL基础科学学院的Majed Chergui领导的一组科学家结束了这场争论。研究人员利用短而充满能量的激光脉冲将小分子从血红素中分离出来。然后,他们使用另一个来自X射线自由电子激光器的短而硬的X射线脉冲来诱导X射线发射(XES),生成一种非常敏感的分子自旋状态指纹,监测血红素随时间的变化。因此,可以确定从平面到半球形以及返回的通路是由自旋态之间的级联引起的。
这项研究的目标是亚硝基肌红蛋白,亚硝基肌红蛋白是一种与一氧化氮分子结合的肌红蛋白。亚硝基肌红蛋白在神经传递、血管扩张调节、血小板聚集和免疫反应中起重要作用。
“我们的研究结论适用于所有血红素蛋白质,”Chergui说。“尤其是血红蛋白在我们呼吸时吸收和释放氧气。虽然这发生在人体的热温度下,但呼吸是由血红素的电子变化控制的。”
原文检索:Femtosecond X-ray emission study of the spin cross-over dynamics in haem proteins
(生物通:伍松)