《Science》世界第一个原生淀粉样蛋白结构解析
这项研究指出,淀粉样蛋白由自身聚集的Orb2组成。Orb2是果蝇版本的mRNA结合胞质多糖基化元件结合(CpEB)蛋白,这种蛋白与长期记忆储存有关。
很长时间以来,淀粉样蛋白被误解是由于蛋白质变质或错误折叠才会产生的没用的东西,它们的形成是随机的且不受调控的过程,在阿尔兹海默、帕金森、亨廷顿和克雅氏病中,这些异常聚集的蛋白质有神经毒性。
Stowers研究所副科学主任Kausik Si解释,我们发现淀粉样蛋白可以在非常特定的时间以及非常特定的细胞中,以非常特定的方式形成。
2003年,Si和他的导师Eric Kandel发现神经系统中存在一种具有适应性功能的淀粉样蛋白。通过小鼠和果蝇的后续研究,Si等人发现,CpEB和Orb2蛋白自聚集体(淀粉样蛋白)对突触的正常功能至关重要:CpEB/Orb2在脑内以不同功能和结构状态存在,最初是一个单体,在突触上抑制翻译,随着记忆形成,这些单体自组装成生物化学活性聚集体,促进突触翻译。这种转换对记忆内存的持久性是必要的。
本文的第一作者Ruben Hervas在研究院期间研究导致疾病的淀粉样蛋白。“我想利用我的生物物理学背景来研究其他淀粉样蛋白的结构特征——那些好的蛋白质,”他说。
2016年Hervas进入Si实验室,研究Orb2结构的最佳方法是用内源蛋白质,而不是重组蛋白(从细菌中提取的),但这困难很多。
重组Orb2与内源性Orb2不同,因为它们不具有生物活性。原始的神经系统环境对保持蛋白的活性构象及其最有趣的特性非常重要。这些特性与蛋白质的自我聚集,以及形成与记忆相关的生物活性淀粉样结构能力有关。
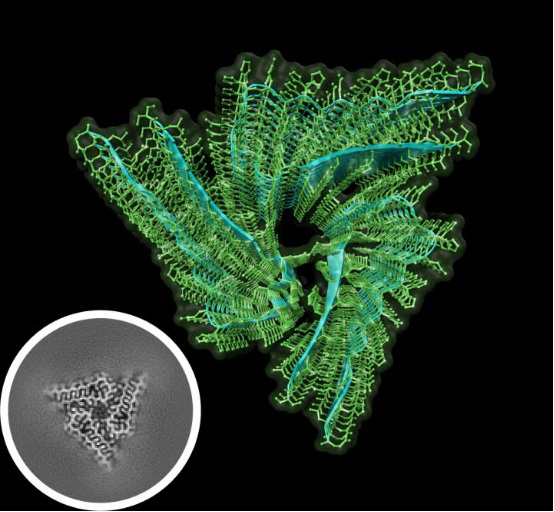
这个蛋白质很大,大约有700个氨基酸,通过X射线晶体学解决的淀粉样结构通常只是由少量氨基酸组成的肽。因此,新结构使用的是低温电子显微镜。
Hervas和同事用了大约300万个果蝇头才纯化出了Orb2样品。这些Orb2以单体、低聚物或自聚集丝(淀粉样)的形式存在。首先,研究人员证实Orb2丝状物能够进一步促进丝状物的形成,它们在单体状态下抑制蛋白质翻译,在寡聚体和丝状物状态下激活蛋白质的翻译。这些纯度超过97%的样品,研究人员用2.6埃的的分辨率解析了内源性果蝇Orb2的结构。
内源性Orb2形成三倍对称的淀粉样纤维,长约75纳米。Orb2在交叉β淀粉样结构中聚集,31种氨基酸组成的原丝核心发卡状褶皱通过亲水界面堆积。
这样一个蛋白是如何帮助储存记忆的呢?作者总结,与致病的淀粉样蛋白的疏水核心不同,Orb2有个亲水核心,因此能够保持稳定,同时调节记忆基质。
小鼠和人类有四种CpEB亚型,每个亚型都有几个变种。现在,研究人员开始从人类内侧颞叶提取CpEB蛋白,先确定其结构,然后再利用小鼠模型建立记忆和蛋白质结构之间的联系。
全文重点总结:
蛋白质的变化构象决定其功能,长期以来,淀粉样蛋白被认为是非功能性的,甚至是致病的。
令人惊讶的是,Kausik Si博士等人发现一种长期记忆形成和维持所必需的蛋白质Orb2的淀粉样蛋白形状是其正常和必要功能的一部分。
新文章以原子级分辨率描述了原生来源(数百万果蝇大脑)的Orb2结构,证明它作为一种功能性淀粉样蛋白的角色。这是全球第一个从大脑中纯化和描述的具有已知生物学功能的淀粉样蛋白。
更有趣的是,Orb2的淀粉样折叠促进记忆相关蛋白产生,而其单体折叠则抑制了记忆相关蛋白的产生。表明这种蛋白可以通过采用多种形状来承担多种功能。
原文检索:Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila
(生物通:伍松)